Trafic et signalisation à travers l’enveloppe bactérienne
Le rôle des métaux à l'interface bactérie / hôte
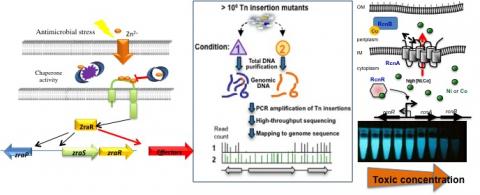
Un transcriptome de D. dadantii dans Arabidopsis a montré que de nombreux transporteurs métalliques sont sévèrement réprimés aux premières heures de l'infection. Un mutant Zur s'est révélé désavantagé lors de l'infection de la plante dans l'analyse Tn-seq réalisée en laboratoire (Royet et al, 2019). La protéine Zur est connue pour contrôler l'homéostasie du Zn chez certaines bactéries, mais elle régule également les fonctions de virulence chez Xanthomonas campestris, les G3E GTPases chez Agrobacterium tumefaciens et une endopeptidase chez Vibrio cholerae. Enfin, nos études récentes ont mis en évidence la fonction du Zn comme alarme de dommages membranaires (Petit-Hartlein et al, 2015, Rome et al, 2018). Ce nouveau concept doit faire l'objet d'études plus approfondies. Le projet consiste à étudier le rôle du Zn, de Zur et du transport des métaux dans la virulence de D. dadantii. Un nombre croissant de publications soulignent le rôle crucial des métaux traces dans l'interaction hôte-bactérie. Toutefois, bon nombre de ces études portent sur le fer et peu sur d'autres métaux à l'heure actuelle. Une approche protéomique sera entreprise (avec l'aide de l'installation de MS de l’IBCP à Lyon) et les protéines candidates feront l'objet d'études plus poussées aux niveaux de leur régulation et de leur fonction.
Implication G. Condemine, E. Guéguen and A. Rodrigue
Etudes structure-fonction du système de sécrétion de type 2 de D. dadantii, T2SS
Les bactéries Gram-négatif utilisent le T2SS pour envoyer des toxines et des hydrolases dans l'environnement externe et dans les tissus de l'hôte. D. dadantii sécrète un ensemble de pectinases et d'autres protéines par le biais d'un T2SS. L'assemblage, l'organisation et la dynamique de cette machine moléculaire, unique mais répandus restent peu connus et font l'objet de nos études. Récemment, nous avons entrepris une vaste analyse comparative pour élucider la structure et la fonction du pilus dans la machine T2SS. Cette étude (ANR SYNERGY_T2SS, début 2019) regroupe trois équipes françaises travaillant sur T2SS et des experts en biologie structurale en RMN et cryo-EM. Nous déterminerons la structure du pilus T2SS et caractériserons sa dynamique et ses interactions avec les substrats sécrétés au niveau atomique. L'utilisation de plusieurs pathogènes modèles nous permettra de développer un modèle commun de T2SS.
Implication V. Shevchik and A. Rodrigue
Un nouveau mécanisme d'attachement covalent des protéines au peptidoglycane
Une étude récente de l’équipe MTSB a montré qu'un composant du T2SS de D. dadantii est lié de façon covalente au peptidoglycane (PG). Dans les années 70, chez les bactéries Gram-négatif, seule la Lpp, aussi appelée lipoprotéine de Braun, est connue pour être liée de façon covalente à le PG, fixant ainsi le PG à la membrane externe. Chez E. coli, six L,D-transpeptidases paralogues sont impliquées soit dans l'attachement Lpp-PG soit dans une réticulation inhabituelle des peptides souches. Ce dernier mécanisme permet aux bactéries de résister aux antibiotiques β-lactames. D. dadantii n'a que quatre de ces L,D-transpeptidases putatives et nous prévoyons d'identifier leur rôle dans la fixation des protéines-PG, leurs implications fonctionnelles pour le T2SS et leur résistance aux β-lactames. Un mécanisme d'attachement protéique similaire, mais profondément différent sur le plan enzymatique, au PG est très répandu chez les bactéries à Gram positif et notre découverte suggère que ce phénomène pourrait également être fréquent chez les bactéries à Gram négatif.
Implication V. Shevchik